版权所有 © 2023 范德耗材 版权所有 津ICP备2023001149号-1
细胞计数和活细胞统计是与各种不同细胞样本类型广泛研究中的关键因素。
本文提供了七个重要点和方法,来提高我们细胞计数的准确性、并确保可重复性,无论是手动细胞计数还是需要使用自动化系统,如:自动细胞计数仪。
1. 清洁细胞计数板表面
无论使用任何细胞计数方法,确保样品表面清洁至关重要,因为任何污染都可能带来不准确的细胞计数结果。
手动细胞计数需要对玻璃盖玻片进行清理(如果选取:BIOFOUNT一次性一体式多孔细胞计数板,可以避免污染问题),首先,使用70%乙醇清洗计数腔,然后用洁净水进行冲洗。使用一次性塑料计数板,每个样品需要一个新的计数腔(同一细胞腔室不能重复使用)。
使用细胞计数仪器,腔室的精度非常重要,其次是使用过程中细胞悬浮液加样腔不能出现气泡。
2. 装载前立即混合
在向细胞计数腔体内加载细胞悬浮液前对悬浮液进行摇匀和混合至关重要。摇匀和混合是确保所测定的样品完全具有代表性(图2)。
不同大小和类型的细胞将以不同的速率聚集和沉淀。在装载样品之前混合溶液可确保等分试样均匀并准确反映细胞培养物的特性。
3. 最小化单元格聚集
细胞计数前需要对整个原液的小样本进行评估,因此需要注意,确保细胞样本可以代表原始原液培养物。
虽然细胞计数仪需要通过复杂的软件算法来识团聚的单个细胞,但细胞计数仪是没有能力对非代表性样本进行校正。当采用手动计数时,每个实验员之间的可变性也很大,主要是细胞聚团后的估算通常比单个细胞更具主观性。
细胞成团通常是由细胞外DNA和细胞裂解后的细胞碎片引起的。细胞裂解可能是由过度生长、冷冻/解冻循环、进行机械剪切以及胰蛋白酶消化不足或过度等因素引起的,当然也可能产生异质性样品。
通过防止细胞裂解的原因或者采取过滤样品中的细胞碎片,可以显著减少细胞团聚问题出现。
4. 优化设置
无论是依靠软件算法进行细胞计数,还是采用显微镜手动细胞计数,对聚焦点和曝光设置来确保细胞的细胞计数过程中的最佳视角,以获得最准确细胞计数结果同样重要。
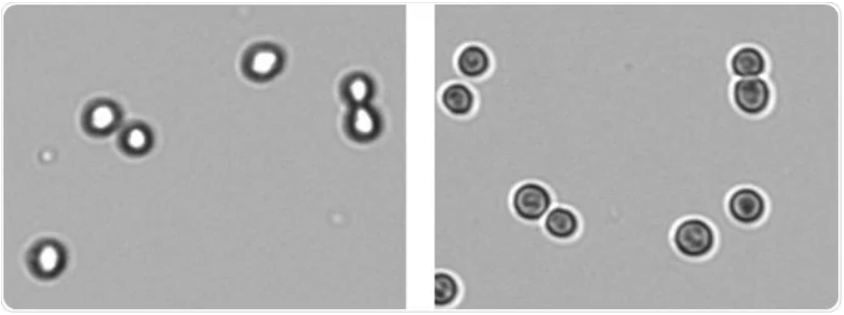
图2-最佳对焦:正确对焦(左)和对焦不良的图像(右)
根据实际情况对聚焦和曝光应进行优化,以达到细胞膜和背景之间的鲜明对比(图2和图3)。
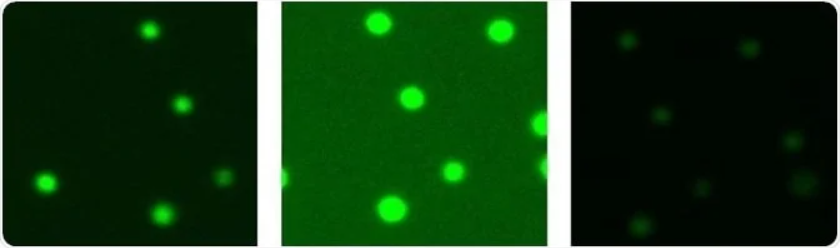
图3-正确曝光(左)、曝光过度(中)、曝光不足(右)
对于荧光应用,需要单独优化每个荧光通道确保可以得到可重复的计数结果。荧光强度的设置需确保细胞处于尽可能亮的水平,同时保持其真实大小。细胞边缘不应有任何光线溢出。
5. 正确选择腔室高度
市面有很多不同品牌和形式的细胞计数板,每种细胞计数板的深度和网格设计各不相同,在进行计算时一定要注意使用正确计算方法和选择有精准的细胞强度深度的细胞计数板,以避免出现错误。
6. 细胞计数参数调整
大多数自动化细胞计数仪都有对细胞大小、光源亮度以及细胞性状进行设置,以便与要统计的细胞样本进行匹配。例如:可以设置要测量的细胞大小范围,以便将碎片或其他细胞群体排除在统计之外。
7. 明场或荧光的选择
明厂分析可以是非常有效的统计细胞悬浮液中的细胞的统计手段。然而,仅应用台盼蓝有时候难以区分活细胞和死细胞,并且对于许多原代细胞或计数分离的细胞核,采用荧光计数可能是更加准确。
例如:外周血单核细胞(PBMC)通常与大量红细胞(RBCs)混合,使用明场分析,这些红细胞可能看起来是“死亡”细胞。
然而,使用吖啶橙(AO)和碘化丙啶(PI)等染料,可以单独染色有核的PBMC,并通过使用双荧光能力区分活细胞、死细胞和无核细胞或碎片。
AO和PI都可以对核酸进行染色,但只有AO具有穿透活细胞膜的能力。因此,活PBMC被AO染色并呈荧光绿色;死亡的PBMC用AO和PI染色并发荧光。RBCs和碎片保持未染色且完全不显示荧光。
技术文章源于:BIOFOUNT耗材公司